新闻中心
中国水稻百年育种的一些关键基因
- 分类:新闻资讯
- 作者:
- 来源:
- 发布时间:2022-03-22 00:00
- 访问量:
【概要描述】水稻育种就是培养新的或者改良性状的品种。传统意义上的育种就是培育“具有一致性、优良性、稳定性的生物群体”。因此,育种的生物学本质就是聚合有利基因型或有利基因型集合。虽然水稻有近万年的人工栽培历史,但是真正意义上的育种只有100年左右时间,即使把人工介入的植物驯化包括在内,也不过2000~3000年的历史,更多的则是自然进化[1]。人类赖以生存的主要农作物的万年演变进化,从遗传学本质上讲,其实就是基因的被动负向淘汰到更多的基因正向选择逐步转变。
中国水稻百年育种的一些关键基因
【概要描述】水稻育种就是培养新的或者改良性状的品种。传统意义上的育种就是培育“具有一致性、优良性、稳定性的生物群体”。因此,育种的生物学本质就是聚合有利基因型或有利基因型集合。虽然水稻有近万年的人工栽培历史,但是真正意义上的育种只有100年左右时间,即使把人工介入的植物驯化包括在内,也不过2000~3000年的历史,更多的则是自然进化[1]。人类赖以生存的主要农作物的万年演变进化,从遗传学本质上讲,其实就是基因的被动负向淘汰到更多的基因正向选择逐步转变。
- 分类:新闻资讯
- 作者:
- 来源:
- 发布时间:2022-03-22 00:00
- 访问量:



水稻育种就是培养新的或者改良性状的品种。传统意义上的育种就是培育“具有一致性、优良性、稳定性的生物群体”。因此,育种的生物学本质就是聚合有利基因型或有利基因型集合。虽然水稻有近万年的人工栽培历史,但是真正意义上的育种只有100年左右时间,即使把人工介入的植物驯化包括在内,也不过2000~3000年的历史,更多的则是自然进化[1]。人类赖以生存的主要农作物的万年演变进化,从遗传学本质上讲,其实就是基因的被动负向淘汰到更多的基因正向选择逐步转变。
第一代(1 G=Generation)育种技术——驯化,大约从1万年前开始,早期的农民并不懂得遗传多样性的理论,但已经开始有意识或无意识对植物进行偶然的选择,他们会选择产量或其他性状表现好的单株作为下一季栽培的种子,并不断繁殖下去。第二代育种技术(2G)——杂交育种技术,始于19世纪中后期,在孟德尔发现了植物遗传定律(1865年左右)后,数量遗传学理论被建立起来,育种家和专业的科学家通过人工杂交的手段,有目的地选配不同亲本进行杂交、自交、回交等,结合双亲的优良性状培育或改良作物品种。第三代育种技术(3G)——传统育种技术,包括杂种优势育种及主动诱变育种。19 世纪末至20 世纪初,英国的一些种子公司开始对植物进行复合杂交(主要是玉米),并从中选择突破性品种。玉米杂种优势和双杂交种在商业化上突出的应用表现带动了杂种优势在水稻、高粱、油菜、棉花等其他作物上的运用。1940 年,物理、化学或太空诱变等手段在作物育种上开始应用,主动的诱变育种可以创造全新的变异,还能促进远缘杂交过程中染色体的变异,对于丰富遗传性状具有重要意义。第四代育种技术(4G)——分子育种技术,得益于现代分子生物学、基因工程的发展,自20 世纪80 年代开始,以转基因(GMO,Genetic Modified Organism)、分子标记辅助选择(MAS,Marker Assisted Selection)、全基因组选择(GS,Genome Selection)、等位基因挖掘等为代表的现代分子技术手段开始在作物育种上运用。GMO 已经发展成最快、应用效率最高的精准育种技术之一。目前在北美地区,90%以上的玉米、大豆作物的抗病、抗虫、抗除草剂性状得到应用并取得了商业化成功。MAS 是20 世纪80 年代兴起的DNA 标记技术,以QTL 作图和RFLP、SSR、SNP 等分子标记为基础,经历了标记开发、遗传图谱、功能和比较基因组连锁分析及基因组测序等不同发展时期。其基本原理是利用与目标基因紧密连锁或表现共分离的分子标记对选择个体进行目标以及全基因组筛选,从而减少连锁累赘,获得目标个体。GS是MAS的延伸,是近年来动、植物分子育种的全新策略,已成为分子技术育种的热点和趋势。分子技术育种是对传统育种理论和技术的重大突破,实现了对基因的直接选择和有效聚合,大幅度缩短了育种年限,极大地提高了育种效率。目前,各国对QTL、MAS、GS和基因定位等精准育种的理论和试验研究很多。许多主粮作物的关键性基因被定位、挖掘、克隆。第五代育种技术(5G)也是我们常说的智能育种[1]。基本定义为利用农作物基因型、表型、环境、遗传资源(例如水稻上的品种系谱信息)等大数据为核心基础,通过人工生物智能技术,在实验室设计培育出一种适合于特定地理区域和环境下的品系品种。而传统上的大田仅仅作为品种测试和验证的场所,从而节省了大量的人力、物力、财力、环境等资源。智能育种是依托多层面生物技术和信息技术,跨学科、多交叉的一种育种方式[1-2]。
水稻进化研究表明,栽培稻(Oryza sativa)是由野生稻(Oryza rufipogon)驯化而来。驯化的主要性状包括株型、落粒性、芒的长短和有无、异交率、产量、休眠性等。控制这些性状的基因有:从匍匐生长到直立生长的基因PROG1[4],从长芒到短芒或无芒的基因LABA1和GAD1[5],从极易落粒到不易落粒的基因sh4和SHA1,从散穗到紧穗的基因OsLG1,控制粒色的基因Rc和Rd,控制粒宽(chr1)、粒质量(chr6)、柱头外露(chr8)等性状的基因[6]。水稻数千上万年的漫长进化,都只是少数几个主效基因起着作用,而最近百余年的水稻育种,研究结果初步表明,也只有一些关键基因发挥了重要作用。
本综述的目的是回顾百年水稻育种进程中的一些关键基因,评价和讨论几次水稻育种技术跨越式发展中起主导作用的一些关键性基因,并预测今后突破性水稻育种技术中的潜力基因。
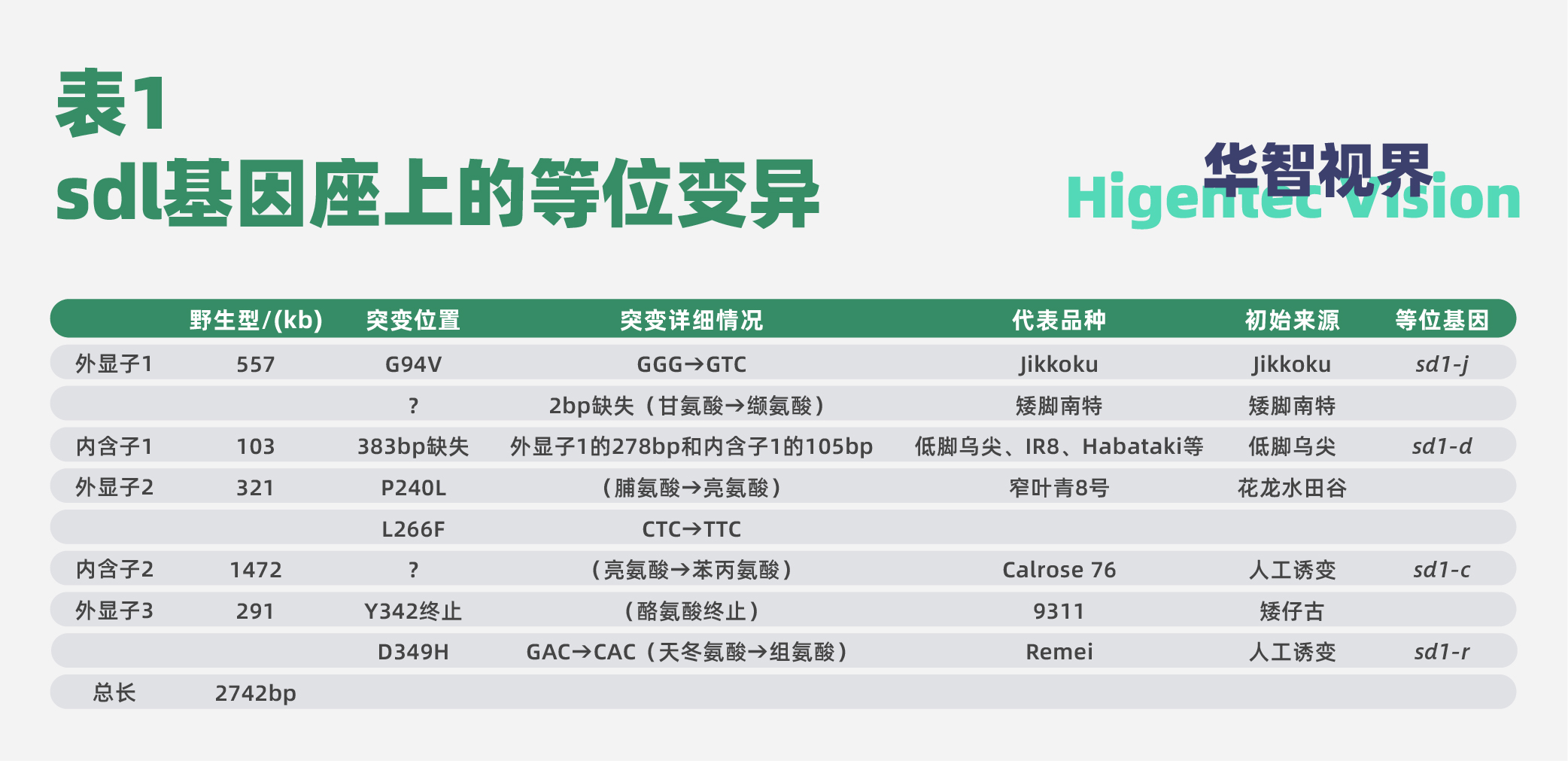
水稻育种的第一次跨越式突破“矮秆育种”的标志性成果虽然在国际上公认是国际水稻研究所1966年育成的IR8,但在1959年我国水稻育种家黄耀祥就通过杂交育种的方法育成了矮秆品种广场矮,1956年广东省农民洪春利、洪群英发现并育成了矮脚南特[3]。IR8、广场矮、矮脚南特可以作为矮秆育种的代表性品种,来探讨其基因的变化(表1)。
水稻育种的第二次跨越式突破“三系法杂交水稻”也是中国率先取得成功,并至今处于世界领导地位。水稻育种的第三次突破“两系法杂交水稻”,从实践到理论的初期开创是以湖北水稻育种家石明松为代表完成的。水稻育种的“三次跨越式突破”加上矮化育种之前的“高秆时代”,中国水稻育种或者种业的发展,基本经历了高秆、矮秆、三系、两系等四个阶段[3]。
1.1 矮秆水稻育种(sd1)
我国自20世纪20年代末开展水稻杂交育种,直至50年代仍然局限于高秆品种,后期倒伏是高秆品种高产的一个关键限制因子。20世纪50年代中期开始的矮秆育种,其标志性事件有:广东省农业科学院黄耀祥团队利用马来西亚引进稻种矮仔占矮源开展育种工作,用系统育种方法选育出矮仔占4号,并以此为亲本与高秆品种广场13杂交,于1959年培育出第一个以杂交育种方法育成的矮秆品种广场矮。
1955年洪群英、洪春利在南特号大田中发现株高仅70 cm的矮秆变异株,穗大粒多高产,命名为矮脚南特并推广应用。同期,台湾学者也在开展矮秆水稻育种。1949年,台湾台中区农业试验场洪秋增以低脚乌尖为母本、菜园种为父本配组,1956年育成台中在来1号,并于1960年推广。
这些事件引起了中国水稻生产的第一次革命,此后,水稻育种进入矮秆时代。同一时期,在国际水稻研究所,JENNINGS 用台湾学者张德慈提供的矮源材料低脚乌尖,与印尼高秆高产的Peta杂交,BEACHELL完成选育工作,1966年育成IR8,因为其高产优质,被称为“奇迹稻”。此后连同矮秆小麦一起,被称之为“绿色革命”[7]。
从高秆到矮秆,水稻进入2G时代。该时代的品种,解决了不抗倒、不耐肥的问题,缩短了生育期,提高了产量,品种分蘖力也有所增强。
水稻2G时代的品种类型主要是矮秆高产常规品种,育种方法主要是杂交选育,利用的变异主要是基因重组,育种理论主要是孟德尔遗传学(基因独立分配、自由组合和连锁交换)。据统计,已发掘命名的水稻矮秆或半矮秆基因已有70个以上,不过有一些是等位的。主导矮秆革命的基因是半矮秆基因sd1。
sd-1控制水稻的株高,在水稻矮化育种中得到了广泛的应用。但是直到2002年sd1才被克隆,被定位在水稻第1染色体上,总长度2742 bp,是由3个外显子和2个内含子组成的开放阅读框,该基因参与赤霉素的生物合成,编码由389个氨基酸组成的GA20氧化酶(GA20ox)。GA20ox是赤霉素合成途径中的关键酶,催化GA53转换为GA20。
通过对矮秆品种中sd1的比较测序,发现sd1的突变主要有7种等位基因型,分别为IR8的383 bp缺失等位基因型、9311外显子提前终止等位基因型、矮脚南特中第一个外显子中2 bp缺失等位基因型,以及4种SD1氨基酸改变的等位基因型,它们的广泛利用推动了矮秆育种的进程。sd1不仅在“第一次绿色革命”中得到选择应用,而且在更早的粳稻驯化过程中就被选择;粳稻中2个功能性的FNPs(SD1-EQ)导致GA20ox2酶活性降低,内源GA含量降低,最终株高降低,而籼稻和野生稻携带了强功能型的SD1(SD1-GR),内源GA含量升高,株高增加。这8个突变的详细情况归纳于表1。
从表1可见,sd1基因座存在较多的等位变异,每个变异都影响赤霉素的生物合成,最终影响水稻的株高。
研究表明,除了影响赤霉素合成的基因(sd1,d18,d35等)影响株高外,还有影响赤霉素信号传导的基因(d1,GID2,GID1,OsSPY等)、影响BR合成的基因(brd1,brd2,d2,dl1,OsDWARF4等)、影响BR信号传导的基因(d61等)、多蘖矮秆基因(D3,HTD3,D27等)影响水稻的株高,仅已知的就多达70多个。不过,在生产上应用的主要是sd1基因。可以说,sd1实现了水稻育种的第一次突破[7]。
1.2 三系杂交稻育种(Rf3和Rf4)
杂交育种的变异来源是有利基因的重组,其品种的优良表现依赖的是基因座位内等位基因的显隐关系和基因座位之间基因的互作。有利基因数目的有限性,导致了产量等性状改良出现了“瓶颈”,人们又开始寻求新的途径实现突破,探索品种间杂种优势利用成为一种途径。
我国水稻杂种优势理论始于1964年杂交水稻之父——袁隆平院士的开创性研究,但之后多年一直没有实践上的突破。直到1970年袁隆平助手李必湖在海南发现花粉败育的野生稻,经全国大协作,三系法杂交水稻育种取得成功。1973年江西颜龙安最先选育出野败籼型不育系珍汕97A,同年张先程最先发现野败籼型不育系的强优势恢复系IR24,几乎同时,袁隆平团队也培育出强优势组合南优2号(二九南1号A/IR24)。我国野败籼型杂交水稻“三系”完成配套,并选配出若干强优势组合,导致了中国水稻育种的第2次突破。1976年籼型杂交稻开始在全国大面积推广,成为世界上第一个成功进行水稻杂种优势商品化利用的国家。我国水稻育种进入3G时代[7]。
水稻3G时代的品种类型主要是矮秆高产三系杂交品种,育种方法主要是三系法育种,利用的变异主要是杂种优势,育种理论主要是细胞质雄性不育理论和杂种优势学说,主导三系革命的基因是水稻“野败”细胞质基因和雄性不育恢复基因Rf3和Rf4。水稻3G时代品种大大增强了分蘖力,提高了耐肥能力,大幅提高了产量,缺点是降低了品质。
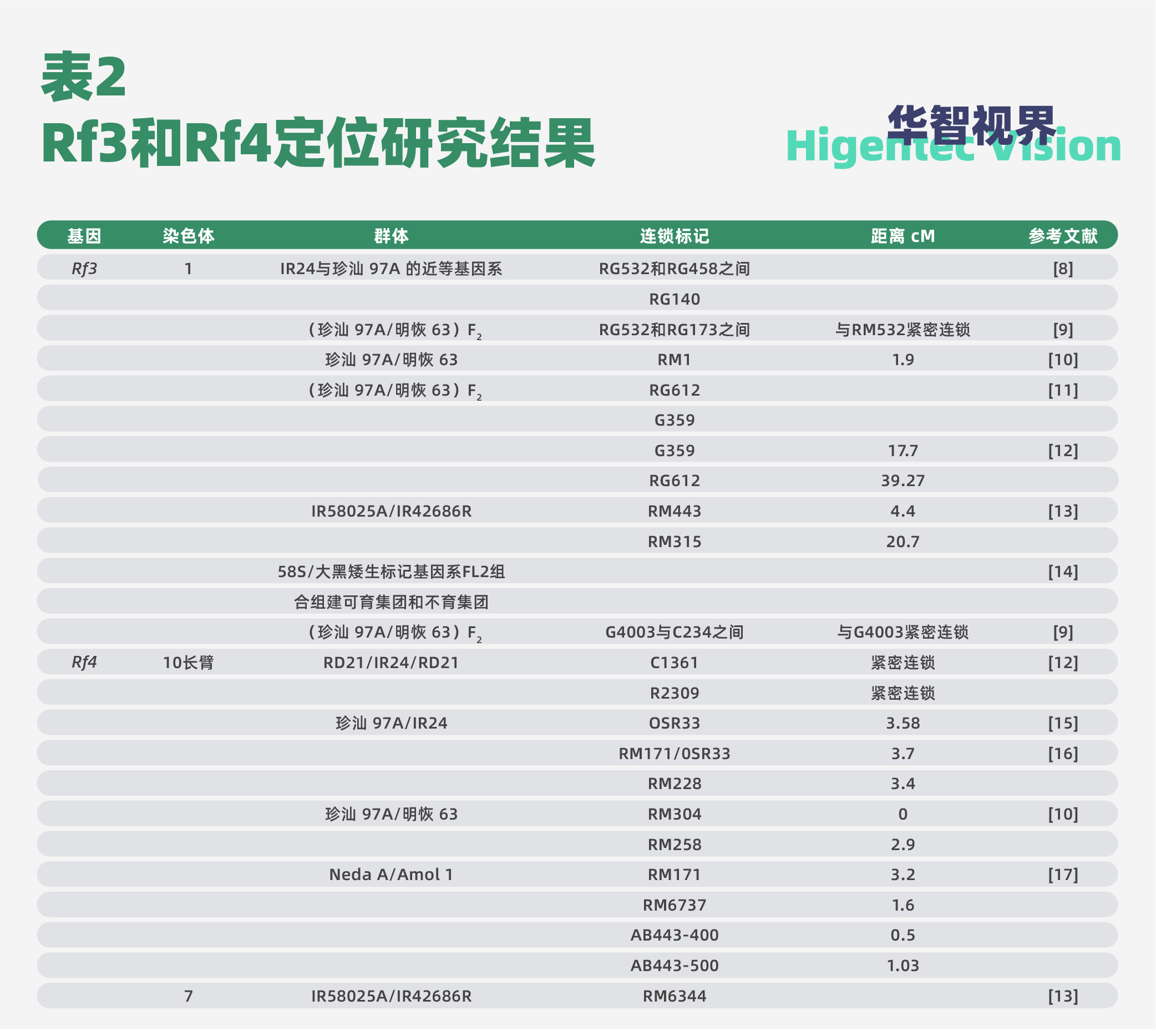
水稻野败型细胞质雄性不育恢复基因Rf3和Rf4能恢复水稻野败型细胞质雄性不育系的育性。Rf3和Rf4定位研究的主要结果汇总于表2。野败型细胞质雄性不育的分子机理得到解析。刘耀光教授课题组报道了一个野生稻线粒体中新近起源的基因WA352,与核编码的线粒体蛋白COX11互作,共同调控水稻野败型细胞质雄性不育性(CMS-WA)。WA352诱导雄性不育可以被Rf3和Rf4恢复,Rf3暂时未被克隆,Rf4编码一个PPR蛋白,可以降低WA352的表达[7]。
1.3 两系杂交稻育种(pms3,tms5)
1973年石明松在晚粳农垦58大田中发现3株雄性不育株,第2年利用其自然结实的种子种植了48株,有雄性不育、可育两种类型。此后6年,他对不育株进行测交和回交时发现,不育株的再生分蘖上能自交结实,分期播种的结果表明育性与光照长度有关。由此,他于1981年提出了水稻育种的全新设想:在长日高温下制种,在短日低温下繁殖,一系两用,提出“两用核不育系”概念,划时代的“两系法杂交水稻育种技术”由此开始[7]。
两系法杂交稻的育性受核基因控制,没有恢保关系,配组自由;稻种资源利用率高,选育出优良组合机率高;亲本种子繁育程序简单,成本低。1986年国家863项目开展两系法杂交水稻全国育种攻关,经过20多年的协作努力,建立了光温敏不育系的两系法杂种优势有效利用的新途径,解决了三系法杂交稻的主要限制因素,使水稻杂种优势利用进入一个新阶段。籼粳亚种间杂交,使得水稻产量、品质又上了一个新台阶,培育出了若干超级稻品种,这可谓是中国水稻研究和生产的第3次大突破,中国水稻育种进入4G时代。
水稻4G时代的品种类型主要是矮秆高产两系杂交品种,育种方法主要是两系法育种,利用的变异也主要是杂种优势,育种理论主要是光温敏核不育理论和杂种优势学说,主导两系法育种的基因是光温敏雄性核不育基因pms3或温敏雄性核不育基因tms5。水稻4G时代的品种进一步提高了产量,增强了抗病能力,稻米品质有了一定改善。
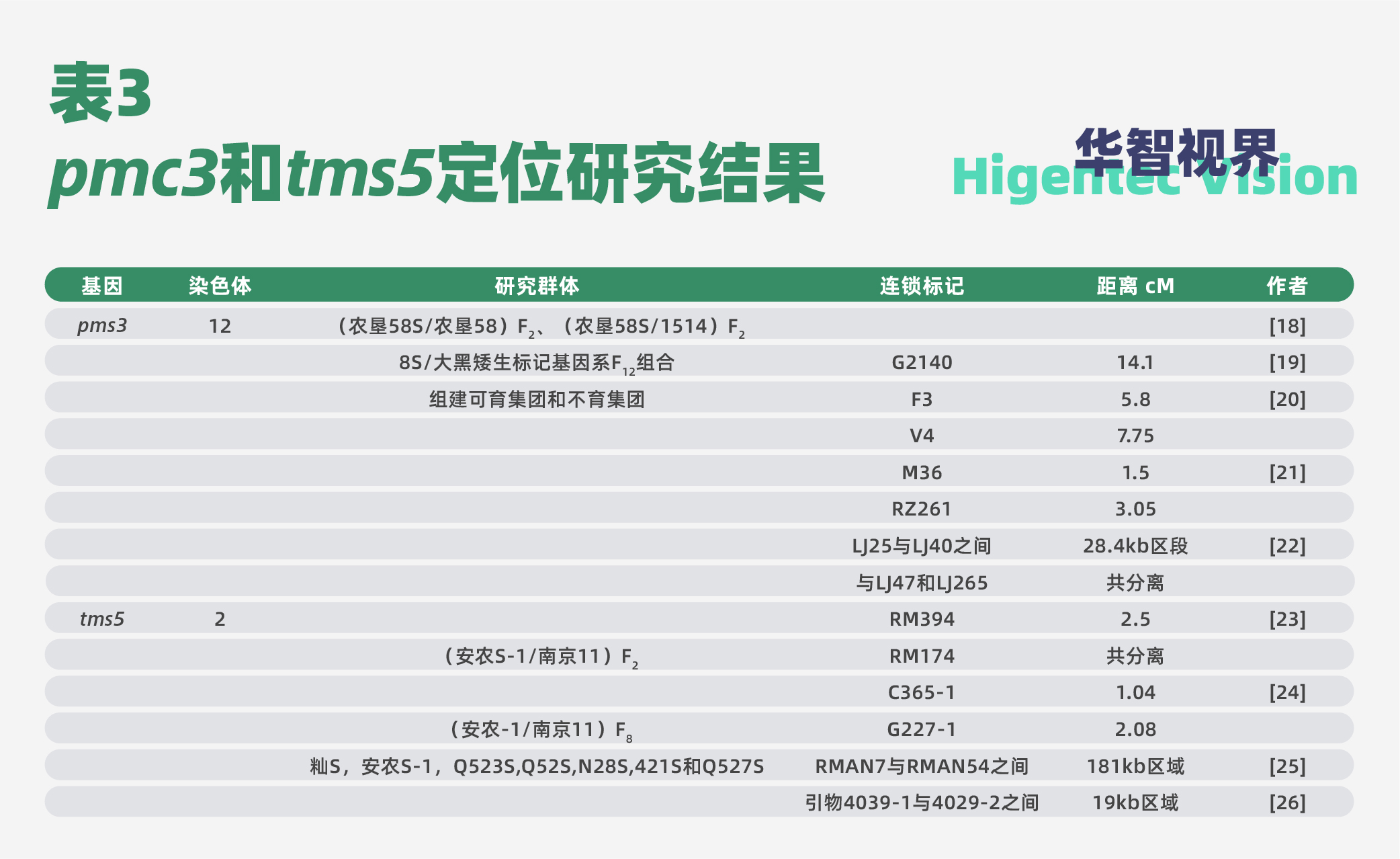
其后,很多学者对pmc3和tms5展开了深入的研究。pms3和tms5基因的定位研究结果汇总于表3。
2.1 抗稻瘟病育种基因Pi
抗病育种是最为经济、环保的植保方法。20世纪60年代中期,日本率先开展了水稻品种抗稻瘟病基因的研究工作,鉴定了最初的8个抗性位点上的14个基因,并建立了一套抗稻瘟病基因分析用的鉴别体系。随后,国际水稻研究所和中国等产稻国也逐渐开展了稻瘟病抗性遗传的系统性研究[27]。
据funRiceGenes数据库记载,截至2022年1月,已至少报道了143个抗稻瘟病相关基因。这些基因成簇地分布于除第3 染色体外的所有水稻染色体上,尤其是第6、11、12染色体上,分别多达15、24和17个。Pi2、Pi9、Pi50、Pigm、Piz、Piz-t 同为Piz 位点上的复等位基因;Pi1、Pik-h/Pi54、Pik-m、Pik-p同为Pik位点上的复等位基因;Pid3与Pi25 等位;Pia与PiCO39等位[28]。
84个基因中,有2个隐性基因(pi21,pi55(t)),82个显性基因;2个穗瘟抗性基因(Pi26和Pib1),82个叶瘟抗性基因;8个数量抗性基因(pi21、Pi34、Pi35(t)、Pib1、Pif、Pikur1、Pikur2、Pise1),76个质量抗性基因[28]。
现已有16个位点上的24个基因被成功克隆,它们是Pib1、Pia、Pib、Pid2、Pid3、Pik、Pik-h/Pi54、Pik-m、Pik-p、Pish、Pit、Pita、Piz-t、Pi1、Pi2、Pi5、Pi9、Pi21、Pi25、Pi36、Pi37、Pi56、Pi63、PiCO39 等[29]。
随着抗稻瘟病基因的发现,抗稻瘟病育种进展加快,2015—2020年我国每年审定的水稻品种中,抗病等级不断提高,抗病品种比例不断增加,基本能达到中抗或者高抗的水平。生产上推广应用的品种,多数品种的稻瘟病较轻。
2.2 抗虫育种基因cry1Ab/cry1Ac
我国水稻抗虫育种明显落后于抗稻瘟病育种,而且重视的是转基因抗螟虫育种。受北美玉米转基因抗虫品种的启发,华中农业大学张启发院士领导的团队,从1997年起就开始抗螟虫转基因水稻研究。华中农业大学培育的转cry1Ab/cry1Ac融合基因的水稻品系明恢63及其所配杂种Bt汕优63在大田种植全生育期不喷施杀虫剂的条件下,抗螟虫效果达到95%以上[30]。1999年开始进行转基因生物安全性评价和申报工作,并于2003年至2004年完成生产性试验,2009年12月首次获得原农业部颁发的生产应用安全证书,有效期为2009年8月17日—2014年8月17日,成为我国首张转基因水稻生产应用安全证书。2021年3月农业农村部再次续发了该转基因水稻生产应用安全证书,转基因抗虫水稻育种的突破,对控制螟虫危害、减少农药用量、保护环境作用巨大。但品种审定之前的区域试验尚不能进行,所以产业化之路仍非常遥远。
3.1 品质育种基因Wx、ALK、Chalk 5、fgr等
水稻遗传育种技术的显著改进,加上中国社会经济快速发展,水稻“第四次育种突破”已初现端倪,可以说中国水稻育种或种业与移动通讯产业同步,正在进入5G时代。
水稻5G时代的典型特征是优质香稻:在品种特性上有优质、高产、抗病、耐热、耐冷、矮秆、抗倒和美味;在品种类型上有常规、三系和两系;在育种技术上有杂交育种、三系育种、两系育种、分子技术辅助育种和基因编辑;在理论基础上有经典和分子遗传学。优质香稻将是5G水稻的最典型特征。主导优质突破的基因有Wx、Chalk、ALK、fgr等。
水稻5G时代的首要目标是米质优和食味好,产量高成为次要目标,抗病、抗倒、耐高温、耐低温、矮秆成为基本条件,外观品质好也是追求目标。米质优正在成为水稻育种的首要目标。当人们解决了吃饱问题后,自然是转向吃好,这是社会发展的必然。水稻育种或种业必然随之转型。
稻米品质是决定一个水稻品种特性的重要指标之一。稻米品质主要包括5个方面:外观品质,包括垩白度、透明度、气味等;加工品质,包括出糙率、整精米率等;蒸煮品质,包括糊化温度、胶稠度等;营养品质,包括蛋白质含量等;食味品质,包括直链淀粉含量、碱消值等。当然,食味方面还有许多亟待研究的问题。
稻米品质性状的遗传,现在研究公认主要与Wx(直链淀粉含量)、ALK(糊化温度)、Chalk5(垩白)等基因有关。
3.1.1 Wx(直链淀粉含量)
Wx基因是食味品质的主要决定因子,位于第6染色体的短臂,该基因编码颗粒淀粉合成酶,控制胚乳直链淀粉含量。研究表明,Wx基因座至少有10个不同功能的等位基因,它们是Wxlv、Wxa、Wxin、Wxop、Wxb、Wxla、Wxmq、Wxmp、Wxhp和wx。Wxlv野生型,源自野生稻;wx是隐性突变基因。wx是Wx基因第2外显子第112碱基处有23bp的重复,引起翻译停止,导致颗粒淀粉合成酶缺失。其他等位基因也是由Wxlv突变分化而来。一般认为,Wxlv在籼稻中自然突变为Wxa,Wxlv在籼稻中经人工诱变突变为Wxin;Wxlv在粳稻中自然突变为Wxb,Wxb经人工诱变突变为Wxmq [31]。
3.1.2 ALK(糊化温度)
糊化温度是仅次于直链淀粉含量的稻米蒸煮品质评价的重要指标,许多文献报道,该性状受一主效基因控制,且在第6染色体短臂的Wx基因附近[32]。因此对水稻糊化温度基因的克隆,有助于水稻品质的分子改良。中国水稻研究所的科研人员采用图位克隆法已成功分离到水稻糊化温度基因ALK,序列分析表明其编码可溶性淀粉合酶Ⅱ。进一步比较不同品种间该基因的DNA序列以及碱消法分析结果,推测出ALK基因编码区内的碱基替换可能引起了支链淀粉晶体层结构的改变,从而导致糊化温度的变化。基因克隆得到了功能互补实验的证实,从而为淀粉合成基因的表达调控提供了理想的材料,为淀粉合成代谢机理的阐明打下了基础。
SSIIa/SSIIIa的双抑制株系呈现垩白、直链淀粉含量增加、糊化温度升高、黏度减小。双突变还降低了短(聚合度DP 5~6)和长(DP 12~23)支链淀粉链的含量、增加了中长型(DP 7~11)支链淀粉的含量。双突变并不表现出加性特征,表明在淀粉合成过程中SSIIa和SSIIIa基因间存在相互作用。参与淀粉合成的主要酶间的成对的酵母双杂交实验表明,SSIIa和SSIIIa基因间互作可能是通过淀粉磷酸化酶发生物理作用。这些结果表明,SSIIa和SSIIIa在水稻籽粒淀粉合成中发挥着不同的但是又有相互重叠的作用[32]。
3.1.3 Chalk 5(垩白)
垩白是灌浆期胚乳淀粉粒和蛋白质颗粒排列疏松而充气所形成的白色不透明部分,不仅影响了稻米可食用性产量(整精米率),同时对稻米外观品质(透明度)、蒸煮食味和营养品质(直链淀粉含量、胶稠度和蛋白质含量)等也都有大的影响。因此,垩白是评价稻米品质的重要指标之一,也是水稻优质和高产的重要限制因子[31,33]。
研究表明,Chalk 5位于第5染色体上,起始密码子前第721位碱基由C突变为T、在起始密码子前第485位碱基由A突变为T,且这2个突变点均为功能突变。进一步研究表明,Chalk 5编码1个液泡膜质子转运焦磷酸酶,具有无机焦磷酸水解活性和质子转运活性,影响水稻籽粒垩白的形成和精米率等品质性状。提高Chalk 5表达增加胚乳垩白,可能是通过干扰发育中种子的内膜转运系统pH稳态来实现,这个过程影响了蛋白体的形成并且与囊泡类结构显著增加相耦连,因此在胚乳储存物质中形成了气体空间,从而导致了籽粒垩白的形成[33]。
3.1.4 fgr/Badh2(香味)
香稻或香米是水稻育种家和企业的追求目标之一,也是消费者的追求。香稻或香米是指自身含有能有效被识别的特殊香味的稻谷或稻米。
稻米的香味受核基因遗传控制,与细胞质基因无关。香味为隐性,非香味为显性。叶片的香味受植株基因型控制,米粒的香味受胚乳基因型控制。有学者认为,稻米香味受1个隐性主效基因座位控制;也有人认为受多个基因座位上的隐性基因控制;还有人认为受主效基因和微效基因共同控制;也有人认为除主效基因外还受多个QTL控制[34]。
水稻香味的遗传基础比较复杂,控制水稻香味的基因座位少则1个,多则4个以上。其原因可能有:(1)香味类型的差异,如爆米花型、茉莉花型、紫罗兰型、山核桃香型等。(2)香味基因与多种环境因素(光、温、肥等)相互作用。(3)香味成分的多样性,目前检测方法不完善。
香味Badh2基因全长1509bp,包含15个外显子和14个内含子,编码503个氨基酸。有学者推断,水稻中的Badh2基因与控制水稻香味性状的隐性基因fgr是同一个基因[34]。
国际机构从20世纪70年代起就对香米的香气成分进行广泛深入的研究。目前最被广为接受的共识是一种叫乙酰基吡咯啉(2-acetyl-1-pyrroline,2-AP)的化合物是香米的主要致香原因。尽管稻米的香味是由200多种不稳定的化合物形成,但2-AP是这种香味形成的主要成分。而且,在其他谷类也发现了这种化合物。
3.2 粒型控制基因GW5、qSW5、GSE5育种
稻米的粒型是一个重要的外观指标。粒长、粒宽、长宽比是比较复杂的数量性状,遗传复杂,受多个QTL控制。其中,研究人员发现了显著影响水稻粒宽和粒质量两个性状连锁的主效基因GW5、qSW5、GSE5等。
GW5精细定位于含有1212bp缺失的21kb基因组区域,在1212bp缺失下游约5kb的区域,有一个编码钙调素结合蛋白的基因,即GW5。存在于宽粒品种的1212bp缺失通过调控GW5的表达量进而调控籽粒大小。利用CRISPR技术将GW5基因敲除,可以增加其他不含1212bp缺失的水稻品种籽粒的粒宽和粒质量,达到增产效果[35]。
利用粳稻品种日本晴和籼稻品种Kasalath杂交构建的F2群体,在第5染色体定位到一个控制粒宽的主效QTL,命名为qSW5。通过图位克隆将qSW5精细定位在2263 bp内,最后通过基因表达分析,以及互补实验确定其中一个ORF(开放阅读框)为qSW5[18]。GSE5编码一个钙调素结合蛋白,可以与水稻钙调素蛋白OsCaM1-1在体内相互作用。GSE5启动子区域的缺失是导致水稻品种粒宽变异的遗传基础。细胞学分析表明,GSE5通过影响种子的细胞数目来控制籽粒宽度和粒型[36]。
3.3 籼粳交杂种优势利用基因S5-n
籼粳交杂交水稻现在已经有了多方面的突破。一是籼粳交杂交稻新品种选育快速发展,至2020年仅甬优系列品种就多达40个,还有春优系列、浙优系列、中嘉优6号和中嘉优9号等。二是农业农村部在确认超级稻品种和国家水稻数据中心在划分品种类型时,均把籼粳交杂交稻作为一个新类型,甬优12、甬优15、浙优18、春优84、甬优538、甬优2640、甬优1540、甬优7850等8个籼粳交杂交稻品种先后被确定为超级稻品种,在2021年有效的135个超级稻中占有不小的比例。三是“籼不粳恢”模式取得较大进展,如湖北省农业科学院选育的“籼不粳恢”杂交稻品种旱优79已通过审定。
广亲和材料的发掘以及籼粳杂种不育基因的克隆和应用是有效解决籼粳杂种不育的根本途径。籼粳杂交品种的育性主要受控于水稻第6染色体的S5位点,由3个紧密连锁的基因ORF3、ORF4和ORF5组成,形成“杀手-保护者”系统。在雌孢子形成过程中,“杀手”ORF5+和“搭档”ORF4+的行为会引起内质网胁迫,“保护者”ORF3+能阻止内质网发生胁迫反应,促进细胞产生正常的配子,但是ORF3–不具这一功能,结果导致提前发生程序性细胞死亡与胚囊败育。典型的籼稻携带ORF3+ORF4-ORF5+组合,而典型的粳稻携带ORF3-ORF4+ORF5-组合;在籼粳杂种中,ORF5+和ORF4+合作杀死雌配子,而携带护卫基因ORF3+的雌配子免于败育[37]。
S5的三等位基因系统是水稻籼粳杂种生殖隔离和杂交亲和性的主要调节因子。日本学者池桥等(1984)根据不同生态型水稻品种间的杂交研究,提出了广亲和基因的假说,认为籼、粳和广亲和品种之间的杂种一代育性受控于水稻第6染色体位点一组复等位基因的相互作用。广亲和基因可有效地克服籼粳之间杂种一代的不育现象。
S5-j位于第6染色体,cDNA全长2495bp,包含3个外显子,编码一个由472个氨基酸组成的蛋白产物。产物包含信号肽、中央结构域、N端小叶和C端小叶。粳稻品种日本晴和Balilla完全一样,第273位为亮氨酸,第471位为颉氨酸;籼稻品种南京11第273位为苯丙氨酸,第471位为丙氨酸,终止密码子下游172 bp处缺失1个A;广亲和品种02428转录起始位点ATG前67bp以及ATG后69bp总共136bp缺失,造成包含信号肽的N端115个氨基酸缺失,导致不能定位到细胞壁上[37]。
综上所述,籼粳杂交稻育种成功的必要条件是克服亚种间杂交不育,其有效途径是广亲和基因S5-n的利用。在籼粳交育种时代,借鉴“玉米杂种优势群”的理论,严格建立父母本各自的杂种优势群,亲本育种在群内进行,配组在群间进行,避免遗传血缘混杂。
4.1 抗虫育种
4.1.1 抗飞虱育种基因Bph
水稻抗病育种特别是抗稻瘟病育种取得明显突破之后,抗虫水稻育种就在期待中。水稻害虫主要有两类,一类是吃叶或吃茎的螟虫,一类是吸汁的针吸式害虫,如蚜虫、蓟马、飞虱等。抗螟虫育种,曾借助转基因技术获得了突破,由于学术界对转基因风险争论的原因,尚未能商业化应用。
褐飞虱是危害水稻生产的重要害虫,利用寄主抗性培育抗褐飞虱品种被认为是防治其危害的有效途径。自20世纪70年代起,各国相继开展了水稻褐飞虱抗性基因的发掘工作,到目前为止,已经鉴定和报道了至少34个抗褐飞虱基因位点,其中显性基因19个、隐性基因15个,已经定位的主效抗褐飞虱基因达43个,有9个位点的抗性基因被克隆,分别是Bph14、Bph15、Bph3、Bph2/26、Bph9/1/7/10/21、Bph18、Bph29、Bph32、Bph6。此外还鉴定了一些重要的抗性QTL[38]。
4.1.2 抗螟虫育种
螟虫是水稻的大敌。转抗螟虫基因水稻的抗虫效果已被实践广为证实,转抗虫基因玉米、棉花、大豆等在全球已有广泛应用,也是一种佐证。对于我国而言,水稻产量稳定始终是粮食安全的重要组成部分,当稻米产不足需、螟虫危害风险加重的情况出现时,中国转抗螟虫基因水稻的商业化应用将有可能。
4.2 抗除草剂育种
在水稻生产中,草害是影响高产、稳产、优质的重要因素之一。随着直播栽培面积的不断扩大,草害问题也越来越严重。据统计,由于稻田杂草的侵害,水稻产量的损失可达40%以上。近年来,除草剂在农业生产上得到大面积推广应用,有效提高了我国水稻的产量,大大减轻了稻作劳动量,降低了水稻生产成本。
除草剂通过抑制杂草代谢过程中的酶系统,使其代谢过程受阻,达到除草的目的。根据此原理,通过物理化学诱变或基因工程的方法对水稻体内靶酶进行修饰,使其对除草剂不敏感,或通过基因工程的方法转入与除草剂有高亲和力的酶,降低除草剂对水稻内源靶酶的影响,减少除草剂对水稻内部代谢作用的干扰,达到水稻具有抗除草剂特性的目的。
通过诱变技术获得抗除草剂水稻在美国早已应用。例如,美国Rice Tec推出了Clearfield XL729、Clearfield XL745、Clearfield XP756、Clearfield Xp534等抗咪草烟除草剂杂交水稻,市场份额高达75%。
近年来,我国不少学者对抗除草剂水稻种质资源进行了广泛研究创制,并取得了许多成果。我国最早通过审定的抗除草剂水稻品种是天津市水稻研究所培育的金粳818。北京大学邓兴旺团队用EMS诱导黄华占获得的抗除草剂突变体洁田稻001,2019年获得植物新品种权授权(授权号:CNA20150959.0),2021年通过安徽省审定(审定编号:皖审稻20212004)。在2020年,荃优洁田1号(荃9331A×洁田稻001,国审稻20206078)、兴农丝占(粤农丝苗/洁田稻001,国审稻20206104)、仲旺丝苗(五山丝苗/洁田稻001,国审稻20206105)已通过国家审定。这预示着洁田稻系列品种可以在市场上应用,成为中国抗除草剂水稻的一个开端。表4是人工诱变和基因编辑获得的一些突变体,其中黄华占EMS突变体已经通过审定,命名为洁田稻001,进入了商业化应用。经过20余年的研究,已知EPSPS、aroA、pat、Bar、protox、P450、bxn、csrl等基因,通过转基因技术可以获得抗特定除草剂的转基因水稻。
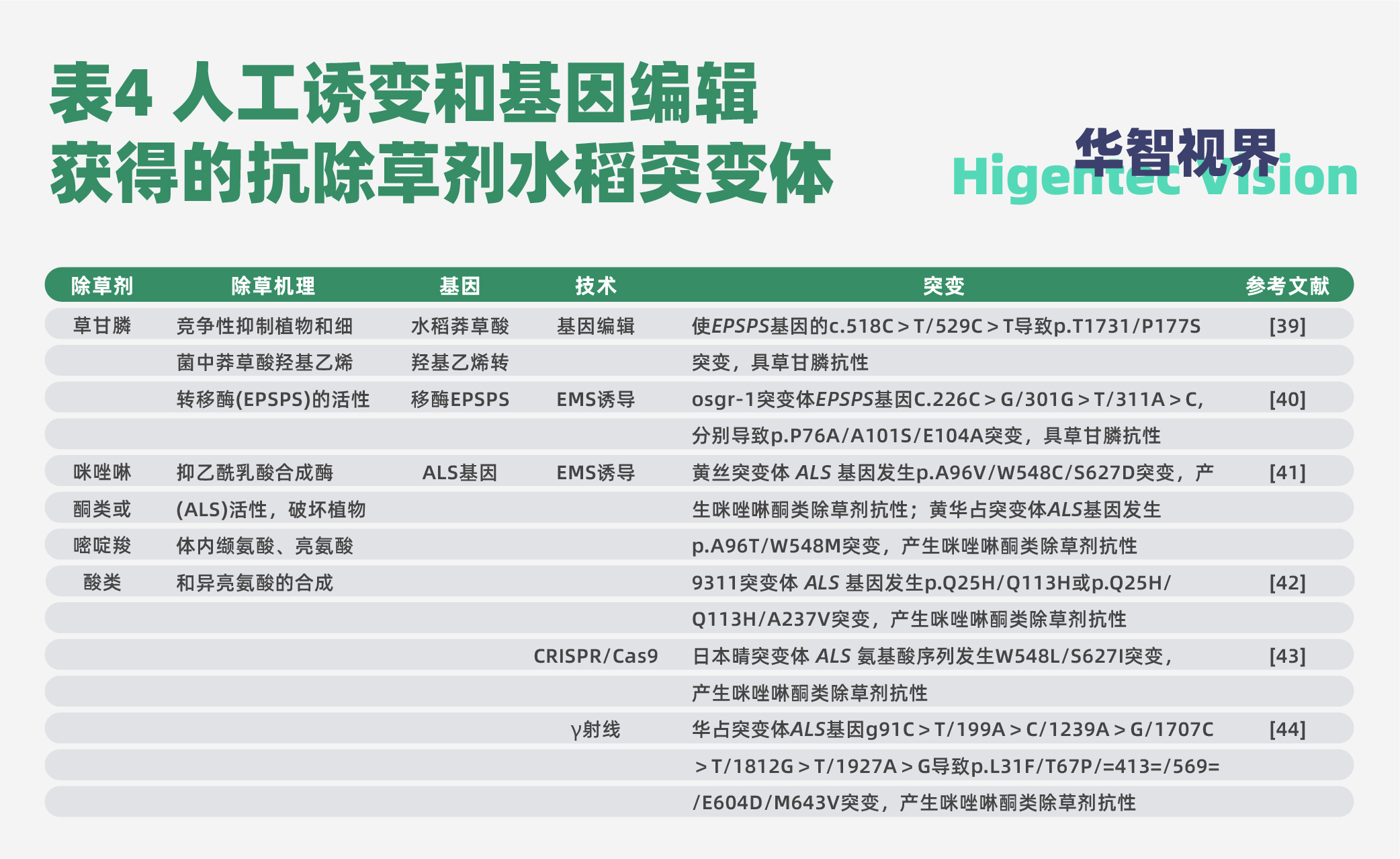
鉴于水稻草害的严重性和水稻轻简化(免耕、直播、机抛)栽培条件下化学除草的必要性,抗除草剂水稻育种商业化应用已经迫在眉睫,诸多基因通过EMS诱变而非转基因途径实现,规避了转基因安全的学术争论,即将引起又一次水稻育种突破。
4.3 多抗性育种技术
随着商业化育种体系的完善,抗倒、耐热、耐冷、耐旱、抗病(稻瘟病以外)等多种抗性育种需求,都会通过育种效率的提高而完成,只不过这种突破不一定能够引起业内直观上的感知而已。
育种就是聚合控制目标性状的基因座位上能产生最佳表现型的有利基因型或有利基因型的集合。因而育种的主要工作就是创造变异、固定或稳定有利变异、选择有利变异。基因编辑技术就是一种创造或创新变异的技术。
基因编辑依赖于经过基因工程改造的核酸酶(分子剪刀),在基因组中特定位置产生位点特异性双链断裂,诱导生物体通过非同源末端连接或同源重组来修复特异性双链断裂,因为这个修复过程容易出错,从而导致靶向突变,这种靶向突变就是基因编辑。基因编辑以其能够高效率地进行定点基因组编辑,被作物育种界寄予厚望。很显然,基因编辑的前提是知道要编辑什么基因。因此,要编辑的基因都是主效基因,所不同的是,基因编辑的基因一般是育种不需要的非有利基因,期望它产生有利突变。迄今为止,分子遗传学家对水稻基因编辑的主效基因列于表5。
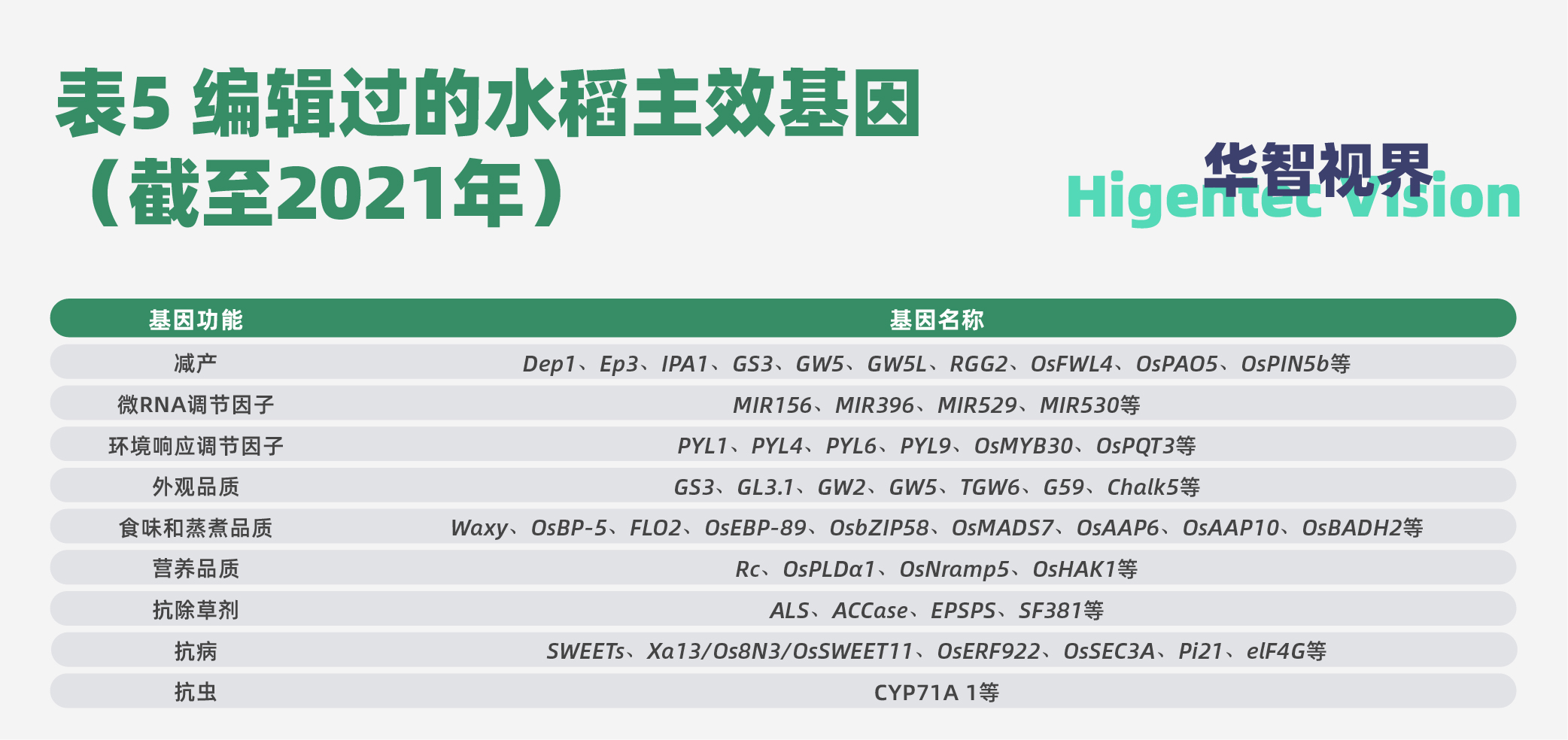
可以预见,随着技术突破,越来越多的水稻基因将被编辑。不过,至今为止,还没有一个基因编辑的水稻品种通过审定。
无论是玉米和水稻的万年自然进化,还是数千年人类参与的人工驯化,或者是人工直接干预的百余年水稻育种,我们都可以清楚看出,水稻从野生稻(Oryza rufipogon)进化为栽培稻(Oryza sativa),变化或驯化的主要性状包括株型、落粒性、芒的长短和有无、异交率、产量、休眠性等,主效基因的改变主导了水稻的进化、驯化和育种突破,其他的基因只是起辅助作用。
回顾百余年的水稻育种,半矮秆基因sd1、野败细胞质雄性不育基因WA352及恢复基因Rf3和Rf4、光温敏核不育基因pms3或温敏核不育基因tms5分别导致了中国水稻育种的三次跨越式突破——矮秆水稻、三系法杂交水稻和两系法杂交水稻。抗稻瘟病基因Pi也可以说引起了中国水稻育种又一次较大突破,只是时间跨度长、抗病基因多、效果没有前三次明显。现在回过头来看,抗稻瘟病品种的普及,对水稻生产的贡献不亚于前面的任何一次跨越式突破,杀菌剂用量减少、稳产性增加、产量损失降低甚至提高,抗稻瘟病育种功不可没。
中国的水稻育种,当前正在发生的似乎有两场变革,一是追求品质的优质育种,包括香稻育种以及实际意义存疑的追求长粒的粒型育种,都可看作优质育种的一部分;二是在保持优质的前提下追求超高产的籼粳交杂种优势利用育种。
可以预见,在不远的将来,“丰(产)优(质)抗(病)、长(粒)香(米)美(味)”将成为水稻育种的主攻方向。水稻的进化从1G到5G,不难发现栽培生产上所要求水稻的主要农艺性状的综合进化,所围绕的也是若干主效基因的聚合。
作者据此推论,未来水稻育种的跨越式突破,无疑仍将由关键主效基因的变化所驱动。最可能发生的水稻育种革命大概率将由抗除草剂、抗飞虱、抗螟虫、耐热、耐冷、抗倒、抗其他病害等主效功能基因所推动。本文阐述和预测的推进水稻育种突破的主效基因归纳于表6。
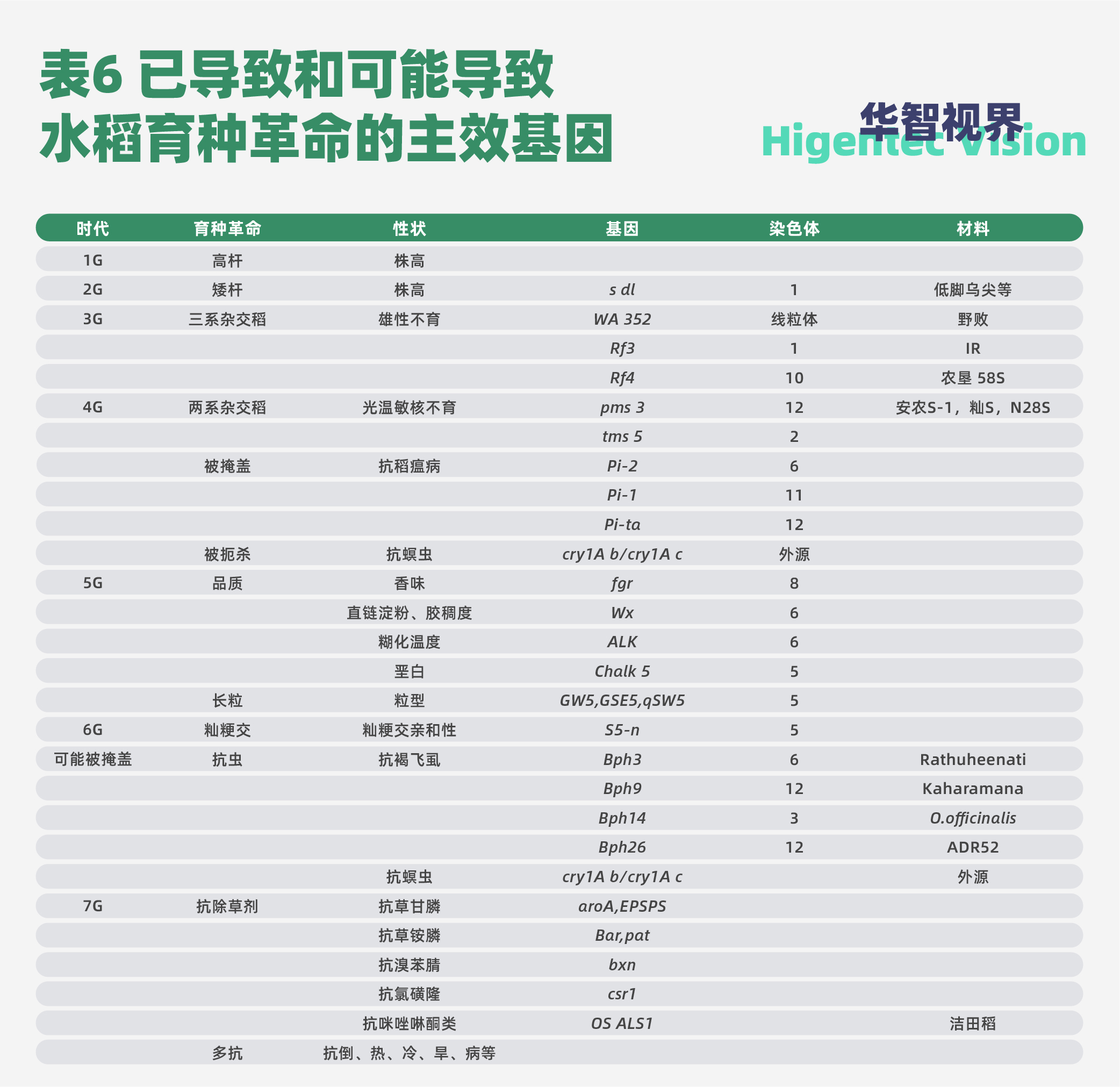
除此之外,水稻育种技术也一直在呼唤变革,基因编辑正在被广泛探索。一般认为,基因编辑仍然是建立在已知的主效基因之上,所不同是,它主要是基于对众多不利等位基因的研究。本文的论述表明,水稻育种一直是在主效基因上做文章。一旦新的主效基因被发掘,该基因所控制的相关农艺性状改良就会突破。这告诫我们,水稻育种创新,就是抓住新的主效基因,加以攻克,取得突破。
参考文献
[1] 应继锋,刘定富,赵健. 第5 代(5G)作物育种技术体系[J]. 中国种业,2020(10):1-3.
[2] 刘定富,赵健,应继锋. 农作物育种的基本要点[J]. 中国稻米,2020,26(6):23-26.
[3] 程式华. 中国水稻育种百年发展与展望[J]. 中国稻米,2021,27(4):1-6.
[4] TAN L, LI X, LIU F, et al. Control of a key transition from prostrate to erect growth in rice domestication[J]. Nature Genetics, 2008, 40(11): 1 360.
[5] HUA L, WANG D R, TAN L, et al. LABA1, a domestication gene associated with long, barbed awns in wild rice[J]. Plant Cell, 2015, 27(7): 1 875-1 888.
[6] VARSHNEY R K, SINHA P, SINGH V K, et al. 5Gs for crop genetic improvement[J]. Current Opinion in Plant Biology, 2020, 56: 190-196.
[7] 程式华 主编. 中国超级稻育种[M]. 北京:科学出版社,2010.
[8] ZHANG G, BHARAJ T S, LU Y, et al. Mapping of the Rf3 nuclear fertility restoring gene for WA cytoplasmic male sterility in rice using RAPD and RFLP markers[J]. Theoretical and Applied Genetics, 1997, 94:27-33.
[9] YAO F Y, XU C G, YU S B, et al. Mapping and genetic analysis of two fertility restorer loci the wide-abortive cytoplasmic male sterility system of rice (Oryza sative L.) [J]. Euphytica, 1997, 98: 183-187.
[10] 何光华,王文明,刘国庆,等. 利用SSR标记定位明恢63的2对恢复基因[J]. 遗传学报,2002(9):798-802.
[11] 梁国华. 水稻三种细胞质雄性不育系的恢复性遗传研究[D]. 广州:华南农业大学,1998.
[12] TAN X L, VANAVI C A, AMORNSILPA S, et al. Genetic analysis of rice CMS-WA fertility restoration based on QTL mapping[J]. Theoretical and Applied Genetics, 1998, 97(5/6): 994-999.
[13] BAZRKAR L , ALI A J , BABAEIAN N A , et al. Tagging of four fertility restorer loci for wild abortive—cytoplasmic male sterility system in rice(Oryza sativa L.) using microsatellite markers[J]. Euphytica, 2008, 164(3): 669-677.
[14] 李子银,林兴华,谢岳峰,等. 利用分子标记定位农垦58S的光敏核不育基因[J]. 植物学报,1999(7):58-62.
[15] 景润春,何予卿,黄青阳,等. 水稻野败型细胞质雄性不育恢复基因的ISSR和SSLP标记分析[J]. 中国农业科学,2000,33(2):6.
[16] JING R C, LI X M, YI P, et al. Mapping fertility-restoring genes of rice WA cytoplasmic male sterility using SSLP markers[J]. Botanical Bulletin of Academia Sinica, 2001, 42(3): 167-171.
[17] AHMADIKHAH A, KARLOV G I. Molecular mapping of the fertility-restoration gene Rf4 for WA-cytoplasmic male sterility in rice[J]. Plant Breeding, 2010, 125(4): 363-367.
[18] 梅明华,陈亮,章志宏,等. 农垦58S光敏不育基因突变位点的确定及pms3区间的进一步作图[J]. 中国科学(C辑),1999,29(3):6.
[19] 李子银,林兴华,谢岳峰,等. 利用分子标记定位农垦58S的光敏核不育基因[J]. 植物学报(英文版),1999,41(7):731-735.
[20] 陈亮,梅明华,徐才国,等. 鉴定与水稻光敏核不育基因pms3连锁的AFLP-RFLP标记[J]. 厦门大学学报(自然科学版),2000,39(4):421-425.
[21] 李香花,王伏林,陆青,等. 水稻光敏核不育基因pms3的精细定位[J]. 作物学报,2002,28(3):310-314.
[22] LU Q, LI X H, GUO D, et al. Localization of pms3, a gene for photoperiod-sensitive genic male sterility, to a 28.4-kb DNA fragment[J]. Molecular Genetics and Genomics, 2005, 273(6): 507-511.
[23] 贾建航,李传友,邓启云,等. 用AFLP标记快速构建遗传连锁图谱并定位一个新基因tms5 [J]. 植物学报(英文版),2003,45(5):614-619.
[24] WANG Y G, XING Q H, DENG Q Y, et al. Fine mapping of the rice thermo-sensitive genic male-sterile gene tms5[J]. Theoretical and Applied Genetics, 2003, 107(5): 917-921.
[25] 姜大刚,卢森,周海,等. 用EST和SSR标记定位水稻温敏不育基因tms5[J]. 科学通报,2006,51(2):148-151.
[26] YANG Q, LIANG C, ZHUANG W, et al. Characterization and identification of the candidate gene of rice thermo-sensitive genic male sterile gene tms5 by mapping[J]. Planta, 2007, 225(2): 321-330.
[27] LIU G, LU G, ZENG L, et al. Two broad-spectrum blast resistance genes, Pi9(t) and Pi2(t), are physically linked on rice chromosome 6[J]. Molecular Genetics & Genomics, 2002, 267(4): 472-480.
[28] QU S, LIU G, ZHOU B, et al. The broad-spectrum blast resistance gene Pi9 encodes an NBS-LRR protein and is a member of a multigene family in rice[J]. Genetics, 2006, 172(3): 1 901-1 914.
[29] BRYAN G T. A single amino acid difference distinguishes resistant and susceptible alleles of the rice blast resistance gene Pi-ta[J]. Plant Cell Online, 2000, 12(11): 2 033-2 046.
[30] 崔旭红,焦晓国,张国安,等. 转Bt基因水稻对稻飞虱及蜘蛛种群数量的影响[J]. 华中农业大学学报,2002,21(4): 356-358.
[31] GAO Z Y, ZENG D L, CUI X, et al. Map-based cloning of the ALK gene, which controls the gelatinization temperature of rice[J]. China Science C Life, 2003, 46(6): 661-668.
[32] ZHANG G, CHENG Z, ZHANG X, et al. Double repression of soluble starch synthase genes SSIIa and SSIIIa in rice (Oryza sativa L.) uncovers interactive effects on the physicochemical properties of starch[J]. Genome, 2011, 54(6): 448-459.
[33] LI Y, FAN C, XING Y, et al. Chalk5 encodes a vacuolar H+-translocating pyrophosphatase influencing grain chalkiness in rice[J]. Nature Genetics, 2014, 46(4): 398-404.
[34] BRADBURY L, HENRY R J, JIN Q, et al. A perfect marker for fragrance genotyping in rice[J]. Molecular Breeding, 2005, 16(4): 279-283.
[35] WENG J, GU S, WAN X, et al. Isolation and initial characterization of GW5, a major QTL associated with rice grain width and weight[J]. Cell Research, 2008, 18(12): 1 199-1 209.
[36] LIU J, CHEN J, ZHENG X, et al. GW5 acts in the brassinosteroid signalling pathway to regulate grain width and weight in rice[J]. Nature Plants, 2017, 3: 17-43.
[37] MI J M, LEI Y, KIM S R, et al. An effective strategy for fertility improvement of indica-japonica hybrid rice by pyramiding S5-n, f5-n, and pf12-j[J]. Molecular Breeding, 2019, 39(9): 1-13.
[38] YAN H M, QIN R, JIN W W, et al. Comparative physical mapping of Bph3 with BAC-FISH in Oryza officinalis and O. sativa[J]. Acta Botanica Sinica, 2002, 44(5): 583-587.
[39] LI J, MENG X, ZONG Y, et al. Gene replacements and insertions in rice by intron targeting using CRISPR-Cas9[J]. Nature Plants, 2016, doi: 10.1038/nplants.2016.139.
[40] 戴燚,赵德刚. 抗草甘膦水稻突变体osgr-1 EPSPS基因克隆及生物信息学分析[J]. 种子,2018,37(3):1-6.
[41] 唐晓艳,柳威,王承旭,等. 水稻抗除草剂蛋白及其在植物育种中的应用:中国,CN 102586215A[P]. 2012-07-18.
[42] 张保龙,陈天子,凌溪铁,等. ALS突变型基因及其蛋白在抗除草剂方面的应用:中国,CN 105779479 B[P]. 2017-07-06.
[43] 夏兰琴,孙永伟,赵云德,等. 利用 CRISPR/Cas9系统定点修饰ALS基因获得抗除草剂水稻的系统及其应用:中国,CN 106811479 A[P]. 2017-06-09.
[44] 周延彪,秦鹏,赵新辉,等. 抗除草剂水稻种质资源研究进展[J]. 杂交水稻,2019,34(1):1-5.
转载自公众号“中国稻米”
TOP

